多篇文章解读科学家们在HIV研究领域取得的新进展!
来源:生物谷原创 2025-11-27 09:42
本文中,小编整理了近期科学家们在HIV研究领域取得的最新研究进展,分享给大家!
【1】每月吃1片就能防 HIV ?PLoS Biol:一种新型HIV抗逆转录病毒口服药来了,长效还抗耐药
doi:10.1371/journal.pbio.3003308
HIV 暴露前预防(PrEP)本是遏制艾滋病蔓延的 “利器”,但现实却总有遗憾——目前最常用的还是每日口服药片,一旦漏服就可能失去保护;而唯一的长效疗法需要每 8 周去医院注射一次,不仅麻烦,还可能因频繁就医暴露隐私,让不少人望而却步。全球每年仍有近 130 万新发 HIV 感染,依从性差、可及性低正是关键 “拦路虎”。
不过近日,在PLOS Biology上发表的一项重磅研究,给无数人带来了新希望:研究者开发出一种叫 MK-8527 的新型口服药,不仅能强效抑制 HIV,还能实现每月吃一次的长效预防,甚至对耐药病毒也有效,目前已进入临床试验阶段。
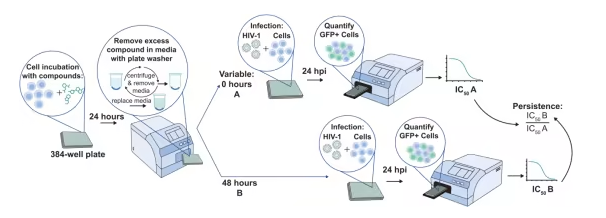
要理解 MK-8527 的厉害之处,得先说说它的 “出身”——它属于一类全新的抗 HIV 药物:核苷逆转录酶易位抑制剂(NRTTI)。这类药物和我们熟悉的传统核苷类药物(NRTI)完全不同,传统药物是 “一刀切” 的 “链终止剂”,一旦嵌入病毒 DNA 就会直接断链,但很容易被病毒的 “ 逃脱机制” 剪掉,从而产生耐药性。
而 NRTTI 则是 “双保险” 策略:它保留了 3′-OH 基团,不会直接断链,但它的 4′- 乙炔基基团能像 “路障” 一样,阻止逆转录酶在病毒 DNA 链上移动,这就是 “立即链终止(ICT)”;就算逆转录酶侥幸绕过 “路障”,MK-8527 还能让病毒 DNA 发生结构扭曲,导致后续核苷酸无法掺入,实现 “延迟链终止(DCT)”。这种双重机制不仅让病毒难以逃脱,还大大降低了耐药风险,这也是它相比传统药物的核心优势。
【2】Science子刊:新研究确定了驱动HIV相关免疫抑制的关键机制
doi:10.1126/scitranslmed.adr3930
马里兰大学医学院人类病毒研究所的研究人员发现,一种特定类型的免疫细胞可能导致HIV感染的持续存在。这一发现为解释为何即使进行有效的抗逆转录病毒治疗,该病毒仍难以治愈提供了新的见解。该研究于本月早些时候发表在《科学·转化医学》杂志上。该研究由马里兰大学医学院药理学教授、IHV病毒学、发病机制与癌症学部主任及免疫治疗学部临时主任Guangming Li博士和Lishan Su博士领导。
研究人员重点关注浆细胞样树突状细胞(plasmacytoid dendritic cells, pDCs)——一种在机体早期抗病毒防御中至关重要的稀有免疫细胞类型。在慢性HIV感染期间,这些细胞变得过度活化,驱动持续的免疫炎症。这种持续的活化会削弱抗病毒的T细胞功能,并使得HIV能够在隐藏的病毒储存库中持续存在。
利用人源化小鼠模型和HIV感染者的血液样本,研究团队发现,减少过度活跃的pDCs有助于恢复抗病毒T细胞功能并缩小病毒储存库。当这种方法与一种免疫检查点抑制剂(一种能使耗竭的免疫细胞恢复活力的疗法)联合使用时,免疫反应得到进一步改善。
【3】Science:两项HIV疫苗试验已证明广泛中和抗体途径的概念
doi:10.1126/science.adr8382
在与HIV(人类免疫缺陷病毒)的长期斗争中,科学家们一直面临一个巨大挑战,即如何训练人体免疫系统产生能够针对多种病毒变体的抗体。由于HIV病毒变异迅速且善于隐藏关键部位以躲避免疫系统的攻击,传统疫苗研发方法大多以失败告终。
然而近日,一篇发表在国际杂志Science上题为“Vaccination with mRNA-encoded nanoparticles drives early maturation of HIV bnAb precursors in humans”的研究报告中,来自Scripps研究所等机构的科学家们结合两项独立的一期临床试验的相关数据表明,一种针对性的疫苗策略能够成功激活与HIV相关的早期免疫反应,并在其中一项试验中进一步推动这些反应的发展,这是疫苗研发领域长期以来梦寐以求的目标。
这项研究涵盖了来自北美和非洲的近80名参与者,为开发具有全球潜力的HIV疫苗奠定了重要基础,其中一项试验测试了一种分步疫苗接种策略,即先注射启动剂量(priming dose),再注射不同的加强剂量(booster dose),从而引导免疫系统经历抗体发展的不同阶段。这种被称为异源加强(heterologous boosting)的技术被证实能进一步推动人体的免疫反应;另一项试验则专注于启动阶段,表明初始疫苗剂量能够成功激活非洲参与者的期望免疫细胞,支持在受HIV影响最严重的地区使用这种方法。两项试验均采用基于mRNA(信使核糖核酸)的疫苗平台进行疫苗接种,类似于新冠疫苗所使用的技术,这就使得疫苗生产更快、临床测试更便捷,并且能产生强大的免疫反应。
【4】Sci Transl Med:HIV治疗遇“幽灵病毒”?科学家发现病毒持续存在的惊人机制!
doi:10.1126/scitranslmed.adu4643
全球约有3900万人携带HIV病毒,其中超过2900万人正在接受抗逆转录病毒治疗,尽管ART疗法能将血液中的病毒载量降至检测不出的水平,但一个令人困惑的现象长期困扰着医学界,部分严格遵医嘱服药的患者,血液中始终能检测到低水平病毒。
这种被称为“不可抑制性病毒血症”(NSV,nonsuppressible viremia)的现象,既非药物耐药所致,也非患者漏服药物造成。近日,发表在国际杂志Science Translational Medicine上题为“Proviruses in CD4+ T cells reactive to autologous antigens contribute to nonsuppressible HIV-1 viremia”的一篇研究报告中,来自约翰霍普金斯大学等机构的科学家们通过研究揭开了这一谜团的关键机制,文章中,研究人员发现,人体内一群特殊的“自我反应性CD4+T细胞”竟成了病毒持续存在的“特洛伊木马”。
文章中,研究人员对8名长期接受ART治疗(中位时间23年)却出现NSV的患者进行了深入分析,这些案例极具代表性,其中一位患者在治疗9年后出现NSV,另一位甚至在与病毒和平共处31年后才出现这一现象。研究者表示,即使100%坚持抗逆转录病毒治疗,大部分HIV感染者仍存在残余病毒血症,NSV仍然是困扰HIV感染者及其医护人员的难题,目前临床管理选择有限。更令人困惑的是,简单地增加抗逆转录药物剂量并不能控制这种病毒血症,病毒就像幽灵般在血液中持续存在,时隐时现。
【5】Lancet Microbe:HIV感染治愈新进展!靶向HIV病毒蛋白Nef可减少感染者体内的潜伏病毒库
doi:10.1016/j.lanmic.2024.101018.
由加拿大西安大略大学研究人员领导的一项新研究首次确定了一个因素,该因素可能会影响人类免疫缺陷病毒(HIV)在细胞内潜伏的口袋在治疗时收缩的速度。相关研究结果发表在Lancet Microbe杂志上。HIV感染很难治愈,部分原因是这种病毒能够创造“潜伏的病毒库”,在那里它隐藏在细胞内处于休眠状态,不会被检测到。西安大略大学医学与牙科教授Jimmy Dikeakos说,“当这种病毒在受感染的细胞内表达时,它会欺骗免疫系统不知道它的存在。”
Nef蛋白在感染期间由HIV表达,保护这种病毒免受免疫检测。这种蛋白减少了细胞表面上的一种分子,而该分子充当标记物,帮助免疫系统识别它是否被感染。这项新的研究发现,Nef蛋白减少这种称为MHC-I的分子的能力与长期抗逆转录病毒治疗(ART)期间HIV潜伏病毒库收缩的速度有关。
Dikeakos说,“对于感染了具有高活性Nef的HIV的人来说,这意味着Nef蛋白真地很擅长从细胞表面消耗MHC-I分子,HIV病毒库的衰减速度比感染了具有低活性Nef的HIV的人慢得多。”这一发现为特异性靶向Nef蛋白的新策略打开了大门,以此帮助改善对HIV感染的治疗。
【6】Science子刊:新研究表明增强CD4+ T细胞中的AST表达可让HIV进入休眠状态
doi:10.1126/sciadv.adu8014
针对HIV感染,目前尚无治愈方法或疫苗。根据HIV.gov的数据,美国约有120万人感染HIV,且每年有4941人因艾滋病(由HIV引发的疾病)死亡。世界卫生组织数据显示,全球约有3990万人感染HIV,每年因HIV相关疾病死亡的人数达63万。HIV的标准治疗方案是每日服用抗逆转录病毒(ART)药物,以阻止这种病毒的复制和传播。ART药物需长期服用,且伴有短期和长期副作用,而基因疗法可能只需一剂。
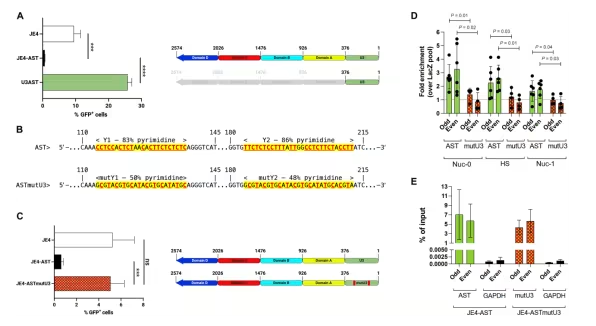
AST的5 ‘末端结构域是与原病毒5 ’ LTR相互作用所必需的
在对感染HIV的人类免疫细胞进行的一项研究中,来自约翰霍普金斯大学医学院的一个研究团队指出,HIV病毒内部的一种分子可以通过操纵和放大,迫使这种病毒进入长期休眠状态,即HIV不再复制的状态。相关研究结果发表在Science Advances杂志上。
论文通讯作者、约翰霍普金斯大学医学院分子与比较病理生物学副教授Fabio Romerio博士表示,这一新发现有助于开发一种促进AST产生的基因疗法。该团队此前已证明,这种为人关注的分子——一种名为“反义转录本(antisense transcript, AST)”的物质——由HIV的遗传物质产生,是使这种病毒进入休眠状态(所谓的病毒潜伏期)的分子途径的一部分。
Romerio指出,即使经过数年ART药物治疗,HIV仍可能残留在体内的细胞和组织中,若感染者停止治疗,这种病毒将迅速扩散。“我们的目标是找到一种提供持久、稳定的HIV治疗方法,”论文第一作者、Romerio实验室博士后研究员Rui Li博士说道。
【7】Nat Microbiol:新研究以前所未有的细节捕捉到进入细胞核的HIV-1病毒核心
doi:10.1038/s41564-025-02054-z
在一项具有里程碑意义的新研究中,由英国钻石光源(Diamond Light Source)电子生物成像中心主任Peijun Zhang教授的一个研究团队揭示了HIV-1病毒如何突破细胞的核屏障——这一发现可能重塑抗病毒策略。他们利用前沿的冷冻电子显微镜(cryo-electron microscopy, cryo-EM)技术,捕捉到了HIV-1病毒核心在进行核输入(nuclear import)过程中的状态——这是病毒生命周期中难以捉摸却至关重要的一步。相关研究结果发表在Nature Microbiology杂志上。
具体而亚,他们使用了细胞透化(cell-permeabilization)技术,这种方法能使细胞膜变得多孔而不破坏细胞本身。他们得以模拟HIV感染人类细胞的过程,并捕捉到近1500个HIV-1病毒核心进入细胞核的瞬间。这项研究揭示,HIV-1成功进入细胞核依赖于其病毒核心的形状和柔韧性、核孔复合体(nuclear pore complex, NPC)的适应性以及宿主因子(如CPSF6)。
CPSF6是一种宿主细胞蛋白,在HIV-1感染的早期阶段,特别是在病毒如何进入细胞核并整合到宿主基因组中,起着至关重要的作用。作为通往细胞核的门户,核孔曾被认为具有刚性的固定结构,只允许特定分子通过。这项研究表明,核孔的适应能力远超想象——它能够扩张和改变形状,以帮助HIV病毒的部分结构(病毒核心)通过。
【8】Science:HIV疫苗研发新突破!科学家精准激活免疫细胞,原子级操控带来新曙光
doi:10.1126/science.adv5572
在全球范围内,约有4000万人正在与HIV病毒顽强抗争,其中三分之二的患者生活在非洲大陆。2023年,超过60万人因HIV相关原因失去了生命,同时有132万人新感染HIV。如今,HIV已成为全球第二大致命传染病,仅次于结核病。然而,迄今为止,尚未有一种有效的HIV疫苗问世。
在这样一个全球健康面临巨大挑战的背景下,HIV疫苗的研发一直是科学界的难题。尽管抗逆转录病毒治疗(ART)能有效控制HIV感染,但疫苗的缺失使得HIV的预防和根除变得极为困难。近年来,mRNA技术和其他新型疫苗平台的发展为HIV疫苗研发带来了新的希望,但如何在人体中诱导产生广泛中和抗体(bnAbs)仍然是关键难题。近日,一篇发表在国际杂志Science上题为“Precise targeting of HIV broadly neutralizing antibody precursors in humans”的研究报告中,来自阿姆斯特丹大学医学中心等机构的科学家们通过人体临床试验取得了突破性进展。他们发现,早期阶段的HIV疫苗能够在人体内引发靶向性的免疫反应,为全球健康领域带来了新的希望。

在HIV疫苗的设计中,传统的疫苗策略往往难以奏效,这是因为HIV病毒具有高度的多样性和快速变异能力。为了开发出有效的HIV疫苗,科学家们需要诱导人体产生广泛中和抗体(bnAbs),这些抗体能识别并中和多种HIV病毒株。然而,激活罕见的bnAb前体B细胞一直是巨大的挑战。在这项研究中,科学家们进行了一项双盲、安慰剂对照的一期临床试验,开发了一种重组、靶向胚系的包膜糖蛋白(Env)三聚体——BG505 SOSIP.v4.1-GT1.1。研究结果表明,这种疫苗在大多数接种者中以高频率诱导了VRC01类bnAb前体。这些bnAb前体针对的是CD4受体结合位点,并且已经经历了VRC01类特有的体细胞超突变。进一步的分析显示,部分分离的VRC01类单克隆抗体能够中和野生型假病毒,并且在结构上与bnAb VRC01极为相似。
【9】Nature:科学家揭示了一种神秘HIV病毒组分的重要功能
doi:10.1038/s41586-025-08624-9
HIV-1(人类免疫缺陷病毒I型)的病毒颗粒能以一种未成熟、非传染性的形式释放,其主要结构多聚蛋白Gag进入功能结构域的蛋白水解切割作用能诱导其重排成为成熟具有传染性的病毒粒子;在未成熟的病毒颗粒中,Gag膜结合结构域MA能形成一种六聚体蛋白质晶格,其在裂解后会经历结构转变成为一种独特的成熟MA晶格结构,目前研究人员并不清楚MA晶格成熟背后的分子机制。
近日,一篇发表在国际杂志Nature上题为“The conserved HIV-1 spacer peptide 2 triggers matrix lattice maturation”的研究报告中,来自德国马普生化研究所等机构的科学家们通过研究发现了HIV生命周期中的一个重要步骤发生背后的分子机制,他们通过联合研究后指出,名为“间隔肽2”(SP2,spacer peptide 2)的神秘病毒组分在将未成熟HIV-1颗粒转化成为感染性颗粒的过程中发挥着关键作用。
HIV-1颗粒能以一种未成熟的非传染性形式从感染细胞中释放出来,病毒颗粒的主要构建原料是一种称之为Gag的大约2000个拷贝的长棒状蛋白质,为了变得具有传染性,HIV就必须经历成熟过程,这主要涉及HIV-1蛋白酶(一种病毒酶类),其能将Gag切割成为六种更小的蛋白质,包括衣壳蛋白和基质蛋白,从而就会引起病毒组分发生巨大的结构重排。多年以来,科学家们一直在探索包裹着基因组的病毒衣壳的结构变化,相比而言,他们对病毒的基质了解的就要少很多,病毒基质是包裹病毒的脂质膜下的特殊外膜蛋白,如今研究人员阐明了这种基质蛋白在成熟成为感染性颗粒的过程中是如何进行重新排列的。
【10】Science子刊:开发强效HIV疫苗有戏!一种针对HIV的新型免疫原促进激活多种产生广泛中和抗体的前体B细胞并让它们获得罕见的体细胞突变
doi:10.1126/scitranslmed.adr2218
HIV疫苗设计的目标是引发广泛中和抗体(bnAb)。通过疫苗接种诱导HIV广泛中和抗体的产生首先需要激活产生广泛中和抗体(bnAb)的多种前体B细胞,然后通过获得几种罕见的体细胞突变增强这些bnAb反应的广度。由于这些前体B细胞在其B细胞受体(BCR)中含有突变,而这些突变在传统的B细胞成熟过程中很少产生,因此HIV疫苗中含有的免疫原必须与携带这些罕见突变的BCR的B细胞强有力地结合并使之扩增。
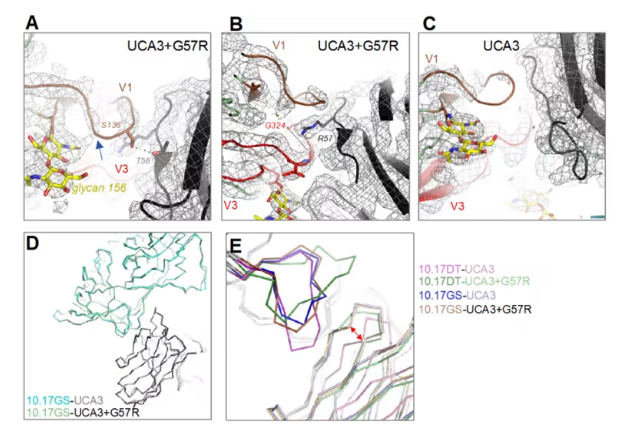
10.17GS与UCA3、UCA3+G57RHC和UCA4的相互作用细节
在一项新的研究中,来自杜克大学人类疫苗研究所的研究人员成功创建了一种HIV候选疫苗,该疫苗引导关键免疫细胞沿着一种进化途径产生bnAb。在小鼠体内,他们使用的免疫原10.17GS激活产生特定bnAb的多种前体B细胞,并在足够高的水平上开始这些抗体的成熟,这使得这种免疫原成为HIV疫苗的有效成分。
相关研究结果发表在2025年1月8日的Science Translational Medicine期刊上,论文标题为“An engineered immunogen activates diverse HIV broadly neutralizing antibody precursors and promotes acquisition of improbable mutations”。
论文通讯作者、杜克大学人类疫苗研究所副教授Mihai L.Azoitei博士说,“成功的疫苗需要诱导大量针对HIV病毒关键区域的抗体,因此这些结果只是这一目标的一部分,但也是一个有希望的步骤。”Azoitei及其同事们在杜克大学人类疫苗研究所先前开发的免疫原版本的基础上,旨在增加这种免疫原引发的突变频率。他们使用计算建模和结构分析来增强这种免疫原激活产生bnAb的不同前体B细胞的能力,并获得导致bnAb的罕见T细胞突变。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


